Rodrigo Antonio Brandão Neto, Júlio César Garcia de Alencar, Heraldo Possolo de Souza, Lucas Oliveira Marino, Gustavo Biz Martins
Sumário
Pontos importantes
- A abordagem inicial do paciente grave deve ser feita de maneira competente, preferencialmente de forma rápida e sistematizada.
- As escalas de triagem reduzem o tempo para o primeiro atendimento de pacientes graves no departamento de emergência (DE).
- O paciente grave no DE geralmente apresenta síndrome clínica relacionada a disfunções isoladas ou combinadas da via aérea, respiração ou ventilação, hemodinâmica ou consciência.
- O paciente encaminhado à sala de emergência deve ser sistematicamente avaliado quanto a responsividade, pulso, respiração, sinais de choque e alterações neurológicas agudas.
- No exame físico, sinais de gravidade devem ser diagnosticados e resolvidos, como estridor, dispneia, hipoxemia, bradi ou taquiarritmias, tempo de enchimento capilar aumentado, cianose de extremidades ou déficit neurológico agudo.
[voltar para o início]
Introdução
Médicos emergencistas devem desenvolver e aperfeiçoar a competência de reconhecer o paciente grave ou com potencial de gravidade de forma rápida, sistemática e precisa. O objetivo inicial é realizar um diagnóstico sindrômico e iniciar o tratamento efetivo o mais precocemente possível.
O paciente grave no DE geralmente apresenta síndrome clínica relacionada a disfunções isoladas ou combinadas da via aérea, respiração ou ventilação, hemodinâmica ou consciência (Figura 5). Assim, quando o paciente é encaminhado para a sala de emergência, esses sistemas devem ser avaliados sistematicamente.
[voltar para o início]
Escalas de triagem
Os departamentos de emergência no Brasil costumam apresentar oferta de serviços assistenciais inferior à demanda de pacientes, acarretamento impacto negativo direto ao cuidado. O atraso no primeiro atendimento pode piorar o prognóstico imediato de pacientes graves. Para minimizar esse efeito, os serviços de saúde devem utilizar escalas de triagem com metodologias eficazes.
A Portaria n. 2048/2002 do Ministério da Saúde define que a triagem classificatória de risco deve ser realizada por profissional de saúde de nível superior, mediante treinamento específico e utilização de protocolos preestabelecidos, e tem por objetivo avaliar o grau de urgência das queixas dos pacientes, colocando-os em ordem de prioridade para o atendimento.
A triagem pode ser realizada através da queixa principal do paciente ou de acordo com os seus sinais vitais, não existindo um consenso na literatura de qual estratégia tem maior benefício. O American College of Emergency Physicians (ACEP) e a Emergency Nurse Association (ENA) recomendam a classificação de pacientes em 5 níveis de gravidade, como o Emergency Severity Index (ESI), o Manchester Triage Scale (MTS) e a Canadian Triage and Acuity Scale (CTAS).
O MTS parece ser acurado em predizer gravidade de pacientes com síndrome coronariana aguda, mas é uma ferramenta pouco útil para predizer gravidade em pacientes com tromboembolismo pulmonar ou sépticos, quando classifica, por exemplo, como prioritários (vermelho ou laranja) apenas 60% dos pacientes com sepse e disfunção hemodinâmica.
Em relação a desfechos no DE, a evidência da literatura é relativamente pobre. Estudos sugerem que o MTS e o ESI são acurados (sensibilidade acima de 90%) em predizer mortalidade no DE de acordo com a classificação de risco do paciente.
Uma estratégia para melhorar a performance das escalas de triagem é a incorporação de dados adicionais, como sinais de alerta no exame físico que, caso estejam alterados, modificariam a classificação. Estudos sugerem que o uso do National Early Warning Score (NEWS) pode aumentar a acurácia e a sensibilidade das escalas, além de poder ser utilizado como fator prognóstico isolado em subgrupo de pacientes, como idosos admitidos por insuficiência respiratória.
Tabela 1
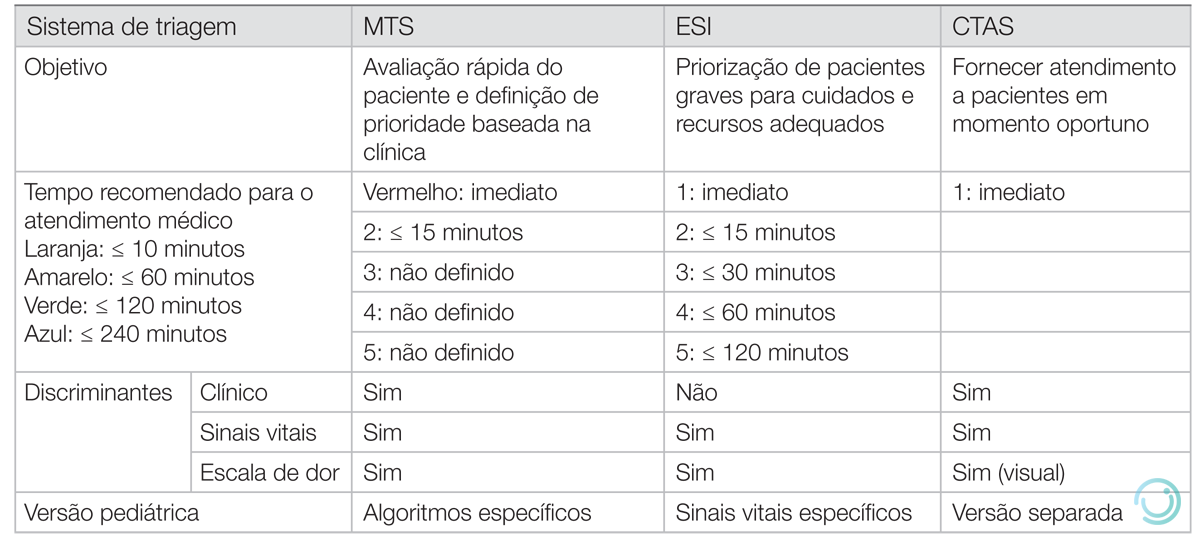
CTAS: Canadian Triage and Acuity Scale; ESI: Emergency Severity Index; MTS: Manchester Triage Scale.
[voltar para o início]
Abordagem inicial na sala de emergência
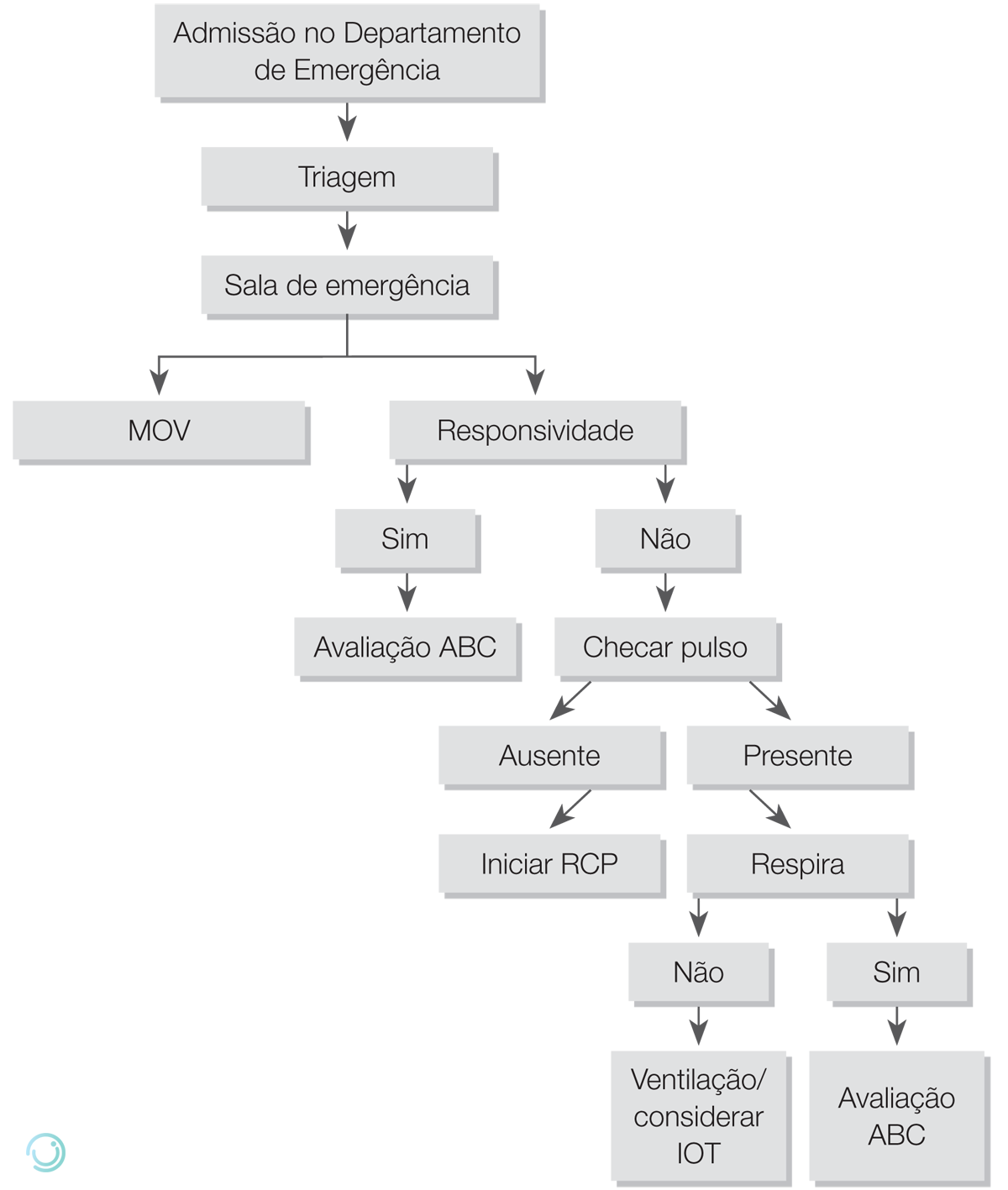
A abordagem inicial do paciente grave na sala de emergência deve ser iniciada pela avaliação da responsividade e do pulso do paciente. Caso não responda e não tenha pulso é necessário iniciar manobras de reanimação cardiopulmonar. Se o paciente responde ou tem pulso, iniciaremos a Monitorização, Suplementação de Oxigênio e Acesso Venoso (MOV) e a avaliação sistemática do paciente grave, didaticamente representada pelo mnemônico ABCDE.
O MOV e o MOVED
Todos os pacientes encaminhados ao DE são elegíveis para monitorização multiparamétrica, oxigenioterapia suplementar e acesso venoso periférico.
A monitorização multiparamétrica é geralmente realizada com pressão arterial (PA), oximetria de pulso, temperatura e cardioscopia. Embora seja uma prática pouco validada na literatura, em nosso serviço adicionamos a mensuração de glicemia capilar ao famoso mnemônico, além da realização de eletrocardiograma em pacientes com queixa de dor torácica ou equivalentes anginosos, como dispneia ou dispepsia.
Monitorização
A monitorização idealmente deve ser realizada em um monitor portátil multiparamétrico, com as seguintes avaliações:
- Pressão arterial não invasiva: é uma medida dinâmica de avaliação da adaptação do paciente ao estresse da patologia emergencial, e serve como um preditor de eventos adversos no DE. Os métodos mais comuns de mensuração de pressão arterial não invasiva são auscultatório (manual) e oscilométrico (monitores). Os métodos oscilométricos demonstram boa acurácia na mensuração da pressão arterial média (PAM) em relação ao padrão-ouro, que é a monitorização invasiva da pressão arterial.
- Oximetria de pulso: a oximetria de pulso mede a porcentagem de hemoglobina arterial que está no estado de oxi-hemoglobina. Ele reflete uma porcentagem que relaciona a quantidade de oxigênio que a hemoglobina está carregando com o máximo que se pode transportar; isso é comumente conhecido como a saturação de oxigênio (SatO2). Além da SatO2 em tempo real, a oximetria de pulso avalia a eficácia das intervenções relacionadas à oxigenação do paciente. A oximetria de pulso tem várias limitações clínicas importantes, entre elas:
- Artefato de movimentação e perda de sinal.
- Estados de baixa perfusão, com componente pulsátil baixo e erros de mensuração.
- Incapacidade de distinção entre hemoglobina normal e condições como metemoglobina (MetHb) e carboxi-hemoglobina (COHb).
- Temperatura: a temperatura axilar é a mais utilizada em nosso meio, e nos ajuda a reconhecer quadros inflamatórios, como infecções, e hipo ou hipertermias ameaçadoras à vida.
- Cardioscopia: é representada pelo traçado eletrocardiográfico, habitualmente na derivação DII, e pela frequência cardíaca.
- Glicemia capilar: apesar de a glicemia não ser um dos parâmetros de monitores, sugerimos sua inclusão como parte essencial dessa etapa, uma vez que os níveis glicêmicos podem guiar nosso raciocínio clínico e terapêutica. No caso de uma hiperglicemia podemos pensar em causas metabólicas e evitar uma intubação catastrófica em um paciente com cetoacidose diabética. E podemos facilmente resolver um rebaixamento do nível de consciência por hipoglicemia com 4 ampolas de glicose 50%.
- Outros parâmetros que podem ser avaliados pelo monitor multiparamétrico, mas que não estão incluídos na abordagem inicial do paciente grave, são:
- Pressão arterial invasiva: indicada em pacientes com instabilidade hemodinâmica persistente ou recorrente; na monitorização de doenças ou de tratamentos com metas de pressão arterial estabelecida (hipertensão intracraniana, síndrome neurovascular, dissecção de aorta, choque séptico etc.); na necessidade de coleta de sangue arterial frequente (por exemplo, em pacientes intubados); ou quando se suspeitar de imprecisões do método oscilométrico não invasivo (por exemplo, obesidade ou arritmias).
- Capnografia.
- Frequência respiratória: mensuração pouco confiável em monitores.
Oxigenioterapia suplementar
No DE, oxigenioterapia suplementar é frequentemente administrada para o tratamento inicial de hipoxemia.
Paciente vítimas de trauma devem receber oxigenioterapia suplementar inicial com máscara facial com reservatório ou máscara não reinalante (MNR) a 15 L/min no atendimento inicial, sendo também a primeira escolha em pacientes admitidos com SatO2 < 85%. Pacientes com SatO2 > 85% devem ter conduta individualizada (Tabela 2).
Tabela 2 Suplementação de oxigênio
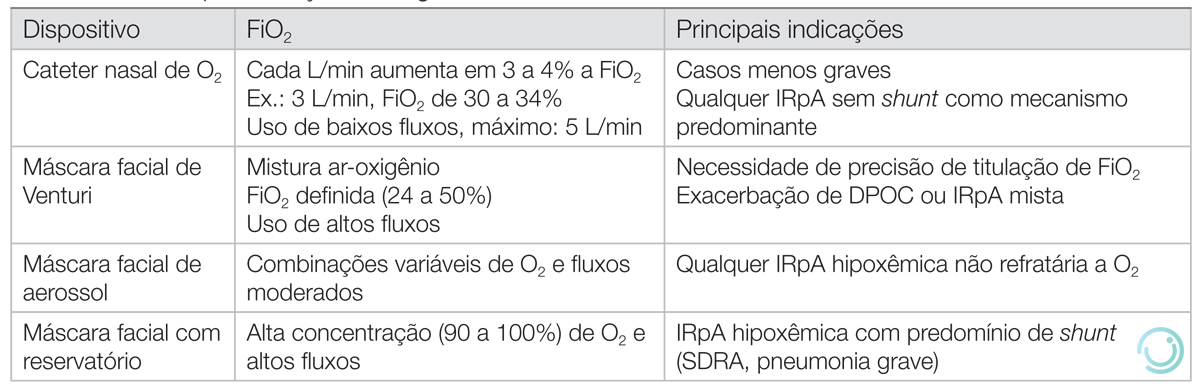
DPOC: doença pulmonar obstrutiva crônica; IRpA: insuficiência respiratória aguda; SDRA: síndrome do desconforto respiratório agudo.
A ventilação não invasiva (VNI) tem benefícios demonstrados nas seguintes indicações:
- Exacerbação de doença pulmonar obstrutiva crônica (DPOC) com acidose respiratória (PaCO2 > 45 mmHg ou pH < 7,3).
- Edema pulmonar cardiogênico.
- Insuficiência respiratória aguda hipoxêmica em pacientes imunossuprimidos.
- Extubação de alto risco (idade > 65 anos; insuficiência cardíaca congestiva [ICC]; DPOC, APACHE II > 12).
Considerar ventilação invasiva em pacientes com alteração de nível de consciência ou falha na terapia com oxigênio suplementar ou com VNI.
Estudos clínicos demonstram que a formação de espécies reativas de oxigênio associadas a hiperóxia causam vasoconstrição coronariana e sistêmica, resultando em piores desfechos para o paciente. Além disso, idealmente, a causa da hipoxemia deve ser diagnosticada e tratada com urgência. Assim, oxigênio deve ser prescrito para alcançar uma SatO2 de 90-98% para a maioria dos pacientes com doença aguda ou SatO2 de 88-92% para pacientes com risco de insuficiência respiratória hipercápnica (como pacientes portadores de doença pulmonar obstrutiva crônica).
Veia (acesso periférico)
A punção venosa idealmente deve estabelecer dois acessos calibrosos (18G ou maior). Devido a dificuldades individuais (obesidade, hipovolemia etc.), muitas vezes essa conduta é inviável. O uso do ultrassom point-of-care para guiar a punção de veias ou dispositivos intraósseos são ferramentas indispensáveis no DE.
ABCDE
O paciente grave deve ser atendido por uma equipe multiprofissional, guiada por um líder competente, que irá avaliar e intervir simultaneamente e de forma integrada. Didaticamente, este capítulo não se aterá às intervenções imediatas, uma vez que cada uma delas depende do diagnóstico sindrômico do paciente, e serão mais bem abordadas ao longo deste livro.
A – Airway (via aérea)
Avaliação da via aérea:
- Checar perviedade da via aérea:
- Há obstrução visível da via aérea?
- Há sinais e sintomas que levantem a suspeita de obstrução de via aérea, como hipersalivação, estridor laríngeo, guincho ou disfonia (hot potato voice ou sinal de batata quente na boca)?
- Checar capacidade de proteção de via aérea:
- Nível de consciência.
- Capacidade de deglutir e eficácia da tosse.
B – Breathing (ventilação)
Devem ser pesquisados sinais ou sintomas de insuficiência respiratória (Tabela 3):
Tabela 3 Parâmetros que podem ser utilizados para avaliar pacientes com desconforto ou insuficiência respiratória

DPOC: doença pulmonar obstrutiva crônica.
- Dispneia ou taquipneia (atentar que bradipneia é um sinal tardio e representa maior gravidade).
- Hipoxemia.
- Movimentos paradoxais da caixa torácica podem indicar obstrução de vias aéreas ou instabilidade da caixa torácica.
- Movimentos unilaterais da caixa torácica podem indicar pneumotórax, derrame pleural ou atelectasia.
- Ausculta anormal (sibilos, estertores etc.) e lembrar que sibilos sugerem broncoespasmo.
- Percussão com hipertimpanismo ou macicez.
- O uso do ultrassom point-of-care pode sugerir etiologias para um paciente admitido com insuficiência respiratória.
Uma das grandes síndromes do paciente grave é a insuficiência respiratória (IRpA), que pode ser dividida em dois subtipos, hipoxêmica ou hipercápnica. O diagnóstico é gasométrico, mas existem características clínicas que nos permitem predizer o subtipo e instituir intervenções antes do resultado do exame.
- Tipo 1: hipoxêmica (PaO2 ≤ 60 mmHg):
- Há falência primária na oxigenação, e geralmente se desenvolve em condições em que a ventilação está inicialmente preservada.
- É decorrente de alteração na relação ventilação/perfusão (V/Q) – efeito shunt ou espaço morto – ou na difusão dos gases pela membrana alveolocapilar.
- Gasometria arterial: hipoxemia deve estar presente, inicialmente sem hipercapnia. A PaCO2 pode estar baixa na tentativa, pois pode acontecer hiperventilação na tentativa de compensar a hipoxemia.
- Tipo 2: hipercápnica (PaCO2 ≥ 45 mmHg):
- Hipercapnia é definida como PaCO2 ≥ 45 mmHg.
- A pressão parcial de CO2 é diretamente proporcional à sua produção (VCO2) e inversamente proporcional à ventilação alveolar (eliminação de CO2). A ventilação alveolar é dependente da ventilação minuto e da relação entre espaço morto e volume corrente. Aumento do espaço morto e redução da ventilação minuto são causas comuns de hipercapnia; já aumento da produção de CO2 raramente resulta em hipercapnia importante devido aos mecanismos de compensação.
C – Circulação
A avaliação inicial da circulação inclui exame clínico dirigido e monitorização dos parâmetros mais importantes (palidez cutânea, presença de pulso periférico, tempo de enchimento capilar [TEC], frequência cardíaca [FC], pressão arterial [PA], eletrocardiograma [ECG] e oximetria).
A história é colhida durante o exame físico, e é importante para identificar a causa das alterações circulatórias, por exemplo, sepse ou infarto agudo do miocárdio. No exame físico, alguns sinais específicos devem ser observados, pois podem indicar gravidade maior do caso:
- Bradicardia importante (< 35 bpm).
- Pulso filiforme.
- Tempo de enchimento capilar > 4 s.
- Pele: fria e úmida, com vasoconstrição e cianose.
- Débito urinário < 0,5 mL/kg/h.
- Estado mental alterado.
Em pacientes com quadro de choque hemorrágico, o controle do sangramento é prioritário.
D – Disability (neurológico)
Nesse momento, deve-se realizar um exame neurológico sistematizado, com intuito diagnóstico, terapêutico e prognóstico. Avalia-se inicialmente a consciência, que é definida como a percepção de si e do meio. As alterações de consciência são divididas em:
- Alterações de conteúdo: estados confusionais agudos, demências etc.
- Alterações de nível: agitação, sonolência, coma etc.
Na avaliação inicial de pacientes alertas e responsivos, deve-se realizar anamnese e exame físico. Já em pacientes irresponsivos, deve-se checar pulso e, se presente, realizar a medida de glicemia capilar e a correção de possível hipoglicemia como primeiras medidas obrigatórias.
O rebaixamento do nível de consciência é sintoma de uma gama diversa de etiologias. No estado de coma, o paciente não pode ser despertado, sendo completamente inconsciente e insensível aos estímulos externos. Pacientes em coma por definição são incapazes de relatar suas histórias, tornando necessária uma rápida coleta de informações com familiares, equipe pré-hospitalar ou testemunhas.
Escalas
Escala de coma de Glasgow
A escala de coma de Glasgow (ECG), apesar de ser amplamente utilizada, possui fatores limitantes que devem ser considerados durante a aplicação:
- Déficits prévios do paciente, como afasia.
- Deficiências prévias, como motora ou surdez.
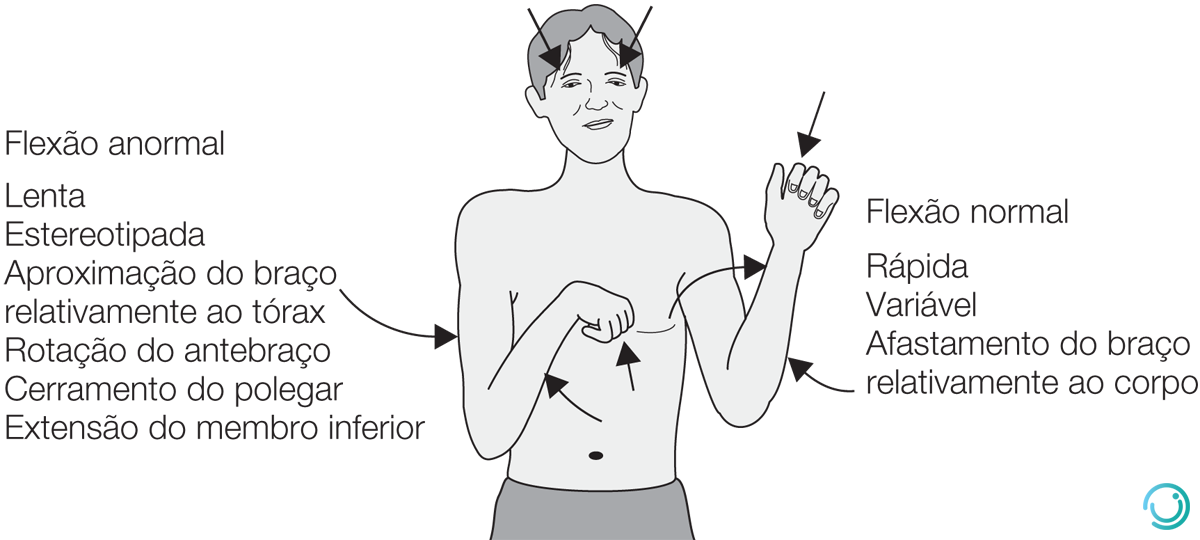
Atentar ainda que o principal indicador de gravidade nessa escala é a pontuação na resposta motora e deve-se pontuar o valor máximo obtido pelo paciente. Por fim, a ECG não deve ser utilizada como parâmetro isolado para indicar via aérea avançada (Tabela 4, Figura 1).
Tabela 4 Escala de coma de Glasgow
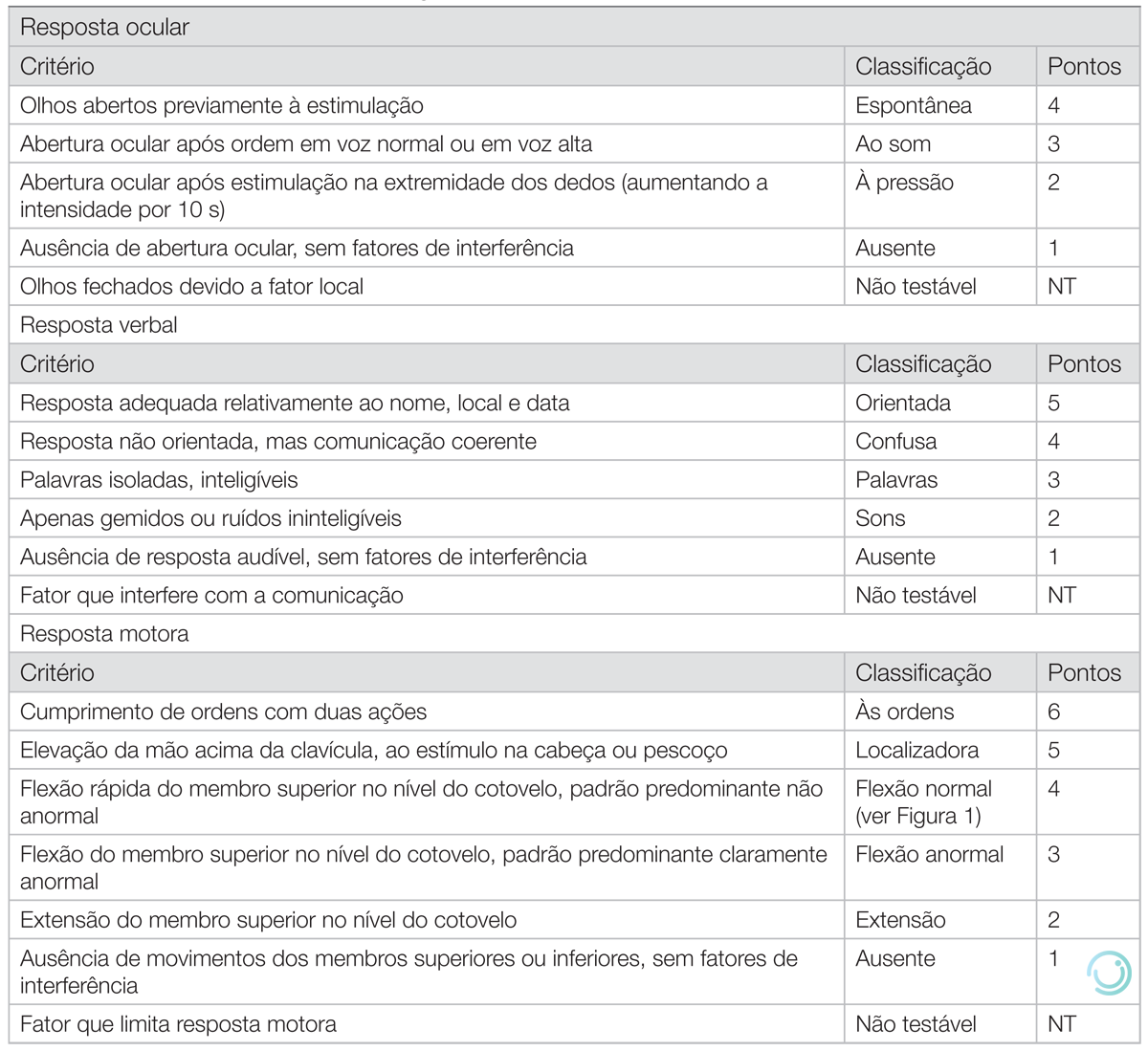
Figura 1 Diferença de padrão de resposta motora entre flexão normal (pontua 4 pontos) e flexão anormal (pontua 3 pontos).
Recentemente foi proposta a inclusão da avaliação pupilar na ECG, retirando pontos do escore final conforme resposta pupilar:
- Resposta pupilar inexistente: nenhuma pupila reage à luz (retira 2 pontos).
- Resposta pupilar parcial: apenas uma pupila reage à luz (retira 1 ponto).
- Resposta pupilar total: ambas as pupilas reagem à luz (não retira pontos).
Essa atualização da ECG está validada para pacientes com trauma, mas ainda carece de validação em pacientes clínicos.
Escala de agitação e sedação de Richmond
A escala de agitação e sedação de Richmond (RASS) é amplamente utilizada para avaliar a agitação e sedação de pacientes, e é uma ferramenta para guiar a dosagem de sedativos (Tabela 5).
Tabela 5 Escala de agitação e sedação de Richmond
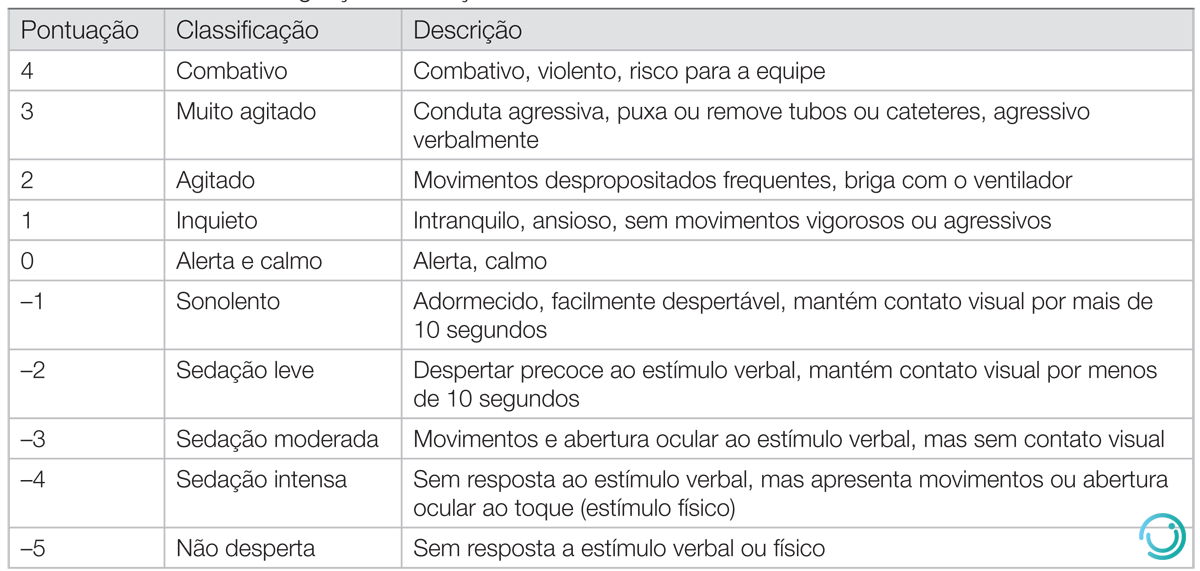
Adaptada de Ely E, Truman B, Shintani A, et al. Monitoring sedation status over time in ICU patients: Reliability and validity of the Richmond agitation-sedation scale (RASS). JAMA. 2003;289(22):2983-91.
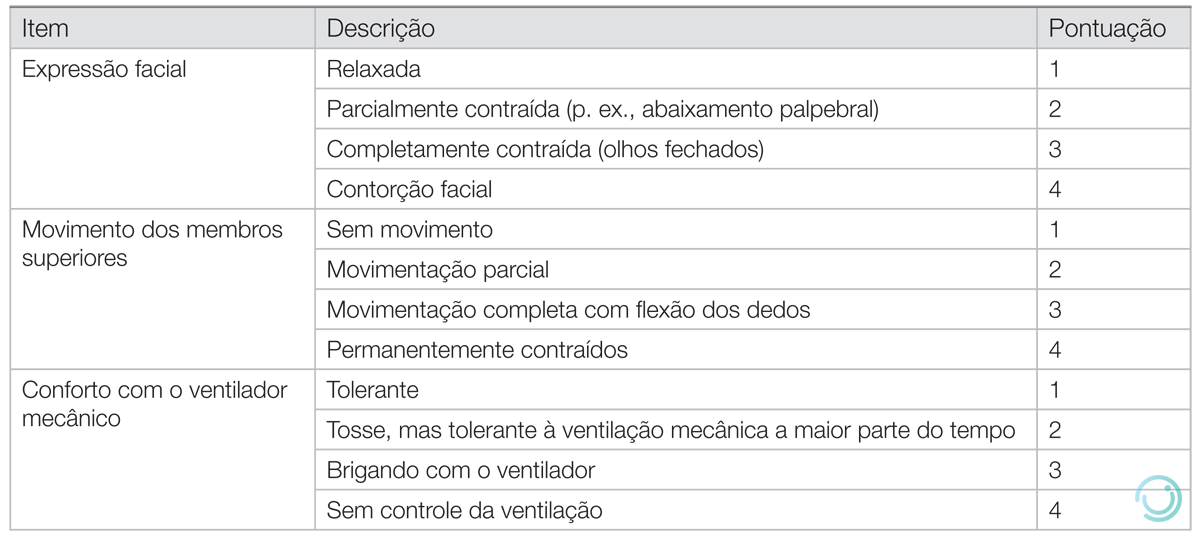
Behavioral Pain Scale
A BPS é uma escala que pode ser utilizada para avaliar a dor de pacientes incapazes de se comunicar, como intubados (Tabela 6).
Tabela 6 Behavioral Pain Scale
Resposta motora
A presença de sinais motores focais, geralmente assimétricos, sugere patologia estrutural do sistema nervoso central com raras exceções. Pode-se avaliar a resposta motora com:
- Observação de movimentação espontânea do paciente.
- Observação dos movimentos apresentados pelo paciente ao estímulo doloroso (leito ungueal, região supraorbitária e esterno, por exemplo).
- Pesquisa de reflexos com atenção à sua presença, simetria e se existem sinais patológicos como o sinal de Babinski.
- Pesquisa do tônus muscular pela movimentação passiva, com atenção a hipertonia, hipotonia e paratonia.
Assim, caracterizam-se alguns padrões motores localizatórios em:
- Hemiparesia dimidiada com comprometimento facial ipsilateral: sugere lesão acima da ponte contralateral.
- Decorticação: sugere lesão ou disfunção supratentorial extensa.
- Descerebração: sugere lesão ou disfunção de tronco cerebral.
- Ausência de resposta motora: sugere lesão periférica, pontina ou bulbar.
Avaliação de pupilas, fundo de olho e ultrassonografia de bainha do nervo óptico
Alterações pupilares podem sugerir a etiologia da alteração do nível de consciência:
- Pupilas puntiformes (< 2 mm): intoxicação por opioide ou lesão pontina.
- Pupilas médio-fixas (4-6 mm) que não respondem à luz: lesão de mesencéfalo.
- Pupilas midriáticas (> 8 mm): intoxicação por anfetaminas ou cocaína ou acometimento do nervo oculomotor.
- Pupila fixa unilateral: lesão do terceiro nervo craniano (oculomotor).
A fundoscopia pode revelar achados diagnósticos, como papiledema, em pacientes com hipertensão intracraniana. Apesar de ser um exame importante, infelizmente não é um exame rotineiramente realizado no DE, tanto por falta de material quanto de treinamento do medico emergencista.
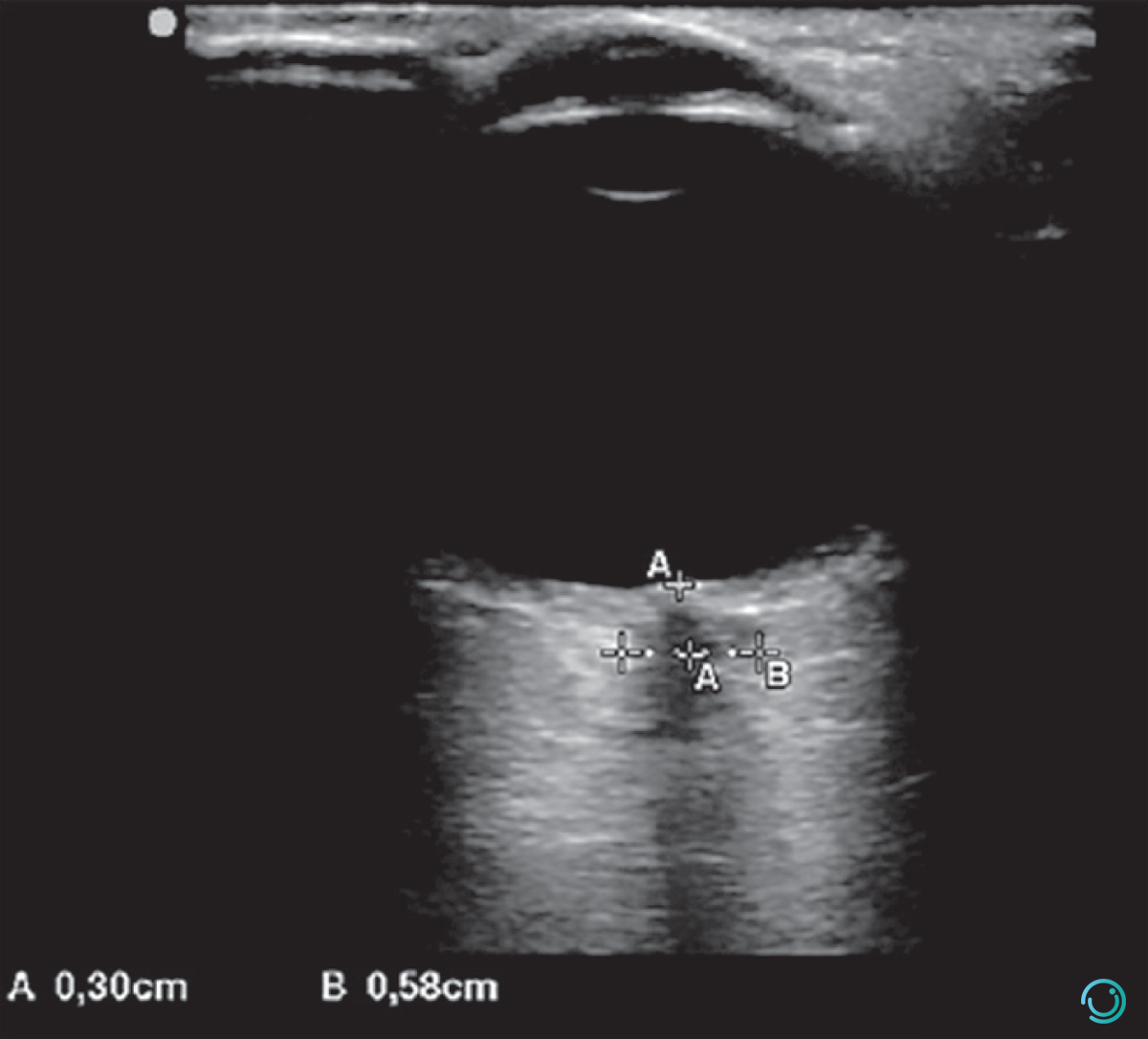
O ultrassom point-of-care (POCUS) permite identificar hipertensão intracraniana. O diâmetro do nervo óptico maior do que 5 mm é um bom indicador de aumento da pressão intracraniana (PIC) (Figura 2).
Figura 2 Mensuração da bainha de nervo óptico em paciente com hipertensão intracraniana.
Padrão respiratório
As seguintes anormalidades de padrão respiratório podem ser úteis (Figura 3):
Figura 3 Padrão respiratório.
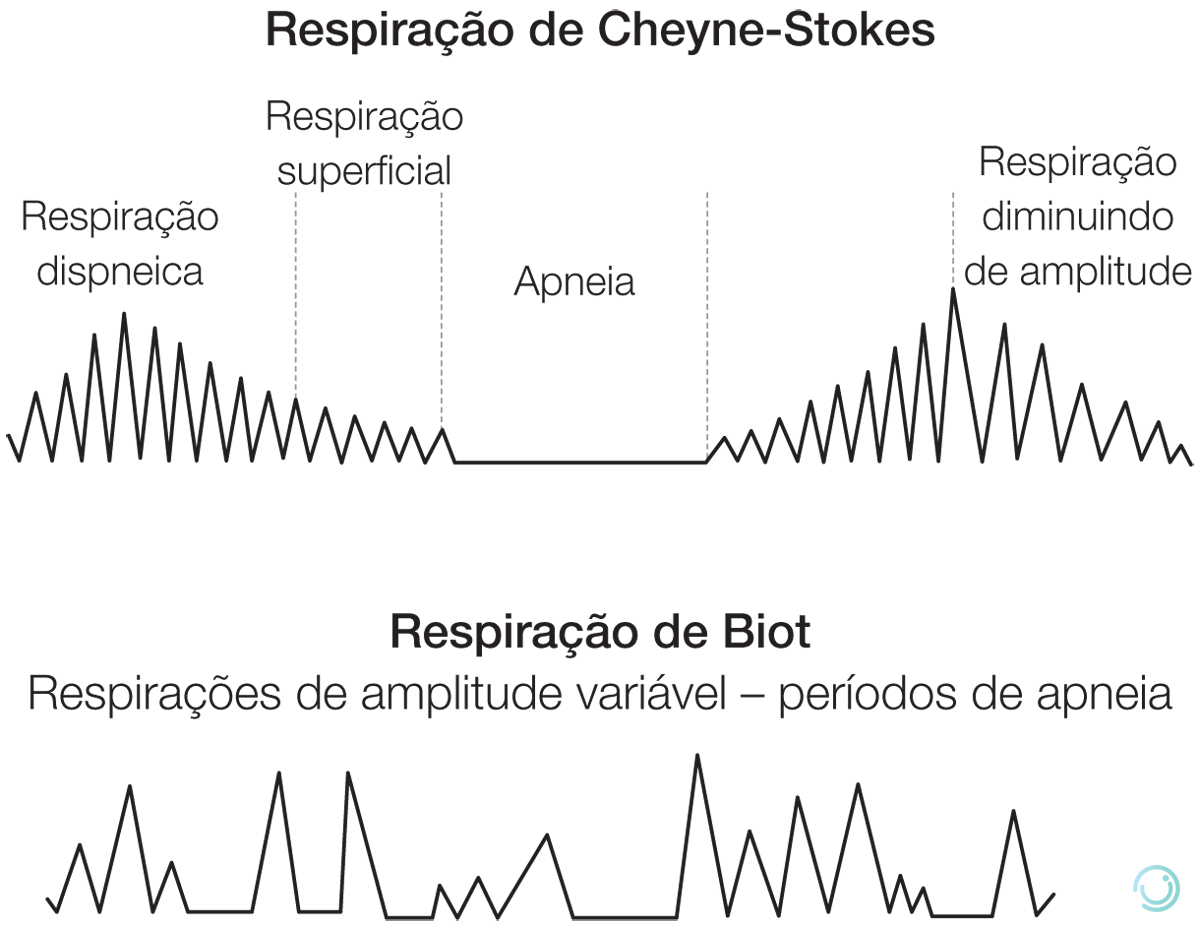
- Respiração de Cheyne-Stokes: pode ocorrer em muitas patologias, como insuficiência cardíaca, e não costuma ser útil no diagnóstico diferencial da etiologia de estados de coma.
- Respiração atáxica (respiração de Biot): padrão anormal de respiração caracterizada por grupos de inspirações seguidas de períodos regulares ou irregulares ou apneia e indica lesão em regiões inferiores, como o bulbo.
- Hiperventilação neurogênica central: padrão anormal de respiração profunda e rápida de pelo menos 25 respirações por minuto e indica uma lesão na ponte ou no mesencéfalo.
Avaliação de pares cranianos
Alterações de pares cranianos podem estar associadas às alterações do nível de consciência, e a avaliação da motricidade ocular extrínseca faz parte dessa avaliação.
Nos pacientes em coma, excluída lesão em coluna cervical, o exame da motricidade ocular extrínseca deve ser realizado pela manobra dos olhos de boneca ou reflexo oculocefálico (Figura 4). Se os movimentos oculares estiverem preservados, a transição pontomesencefálica estará provavelmente íntegra. Quando existe comprometimento dos movimentos oculares, a etiologia provável é lesão estrutural infratentorial, como lesões de tronco, sejam primárias ou secundárias. Se a alteração é do olhar horizontal, possivelmente a lesão é pontina. Se a alteração é do olhar conjugado vertical, é provável que a lesão seja mesencefálica.
Figura 4 Reflexo oculocefálico.

Investigação etiológica e diferenciação de encefalopatia focal e difusa
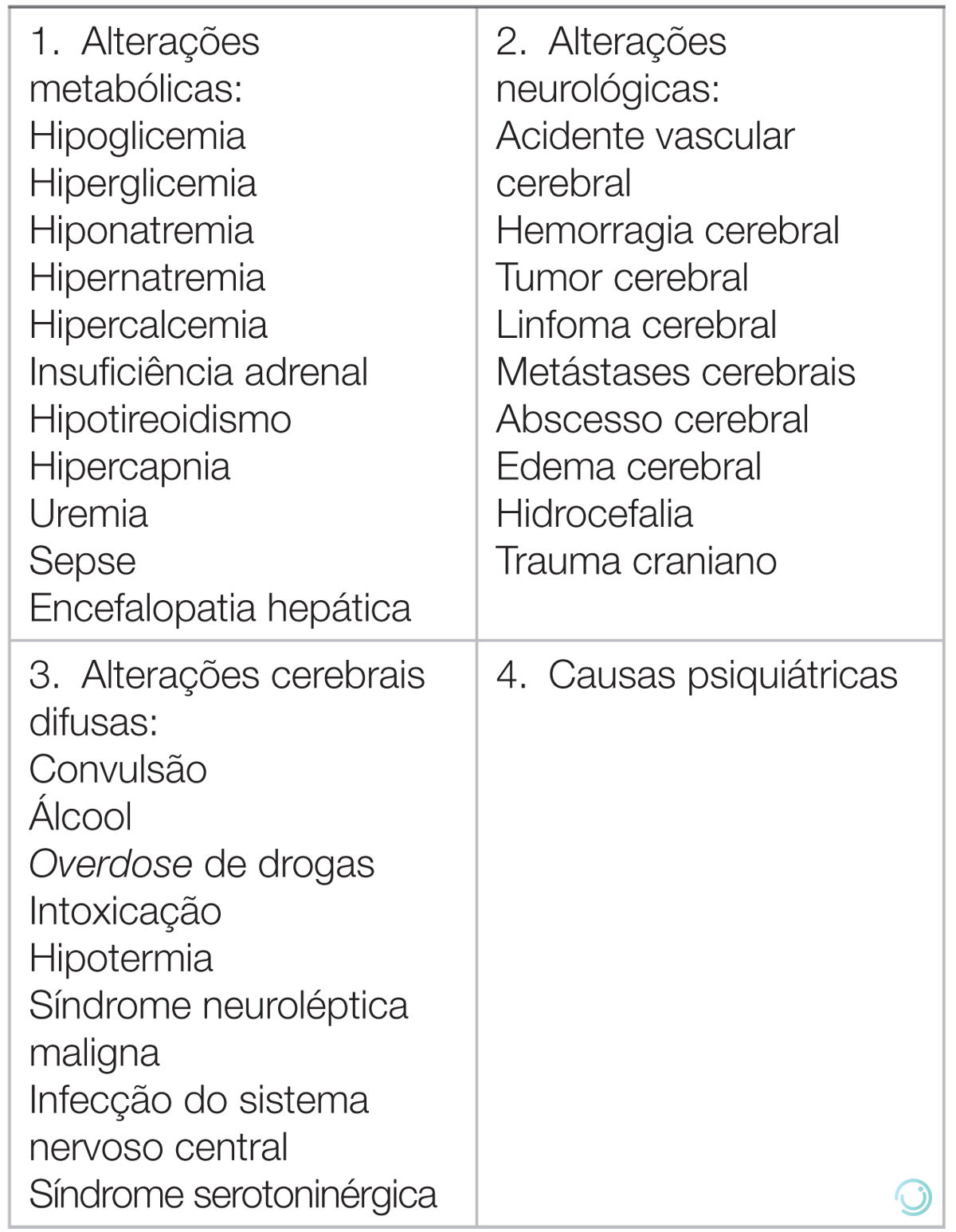
Existe uma ampla variedade de diagnósticos diferenciais que podem cursar com alteração do nível de consciência. Em cerca de dois terços dos casos, a etiologia é tóxico-metabólica-infecciosa, causando uma encefalopatia difusa.
Pacientes com rebaixamento do nível de consciência e dados sugestivos de lesões focais (p. ex., hemiplegia, disartria ou anisocoria) devem sempre ser submetidos a exame de imagem intracraniano. Com exceção de casos de hipoglicemia, intoxicação, convulsão e uremia (stroke mimic), o achado de encefalopatia focal quase sempre se relaciona a causas estruturais.
A tomografia computadorizada (TC) de crânio sem contraste deve ser realizada em todos os casos em que a etiologia do rebaixamento do nível de consciência não é rapidamente identificada por anamnese e exame físico. Em caso de dúvida diagnóstica, a ressonância magnética (RM) de crânio pode ser realizada. Alguns exemplos de achados de imagem nestes pacientes incluem:
- Hemorragia subaracnóidea: hemorragia nos espaços liquóricos (cisternas, convexidade). TC tem sensibilidade de 98% quando realizada em até 12 horas após o início dos sintomas.
- Hematoma subdural: imagem em forma de foice ou crescente.
- Hematoma extradural: imagem biconvexa.
- Acidente vascular cerebral (AVC) isquêmico: a primeira alteração observada é a perda de diferenciação entre substância cinzenta e branca.
- Tumores cerebrais: lesão hipodensa, geralmente cercada por edema (devido à quebra da barreira hematoencefálica).
- Hidrocefalia: dilatação dos ventrículos.
Está indicada a realização de punção liquórica (LCR) nos casos em que o diagnóstico não se esclarece com o exame de imagem ou inicialmente em pacientes com suspeita de infecção do sistema nervoso central (SNC). Além de fornecer a medida da pressão intracraniana, a análise do LCR auxilia no diagnóstico de doenças inflamatórias, infecciosas, vasculares (como hemorragia subaracnóidea [HSA]) e neoplásicas do SNC. Em geral, a TC precede a punção do LCR devido ao risco de herniação cerebral com a punção. Por isso, deve-se atentar para a existência de sinais radiológicos de hipertensão intracraniana grave.
A Tabela 7 cita os principais exames laboratoriais indicados na avaliação de pacientes com alteração do nível de consciência.
Tabela 7 Exames complementares em alteração do nível de consciência

INR: razão normatizada internacional.
Na Tabela 8 é resumido o diagnóstico diferencial em pacientes com rebaixamento do nível de consciência.
Tabela 8 Diagnóstico diferencial da alteração do nível de consciência
E – Exposure (exposição)
Por fim, na avaliação do paciente grave no DE, deve-se considerar despir o paciente e buscar ativamente por lesões, controlar a temperatura e afastar corpos estranhos que justifiquem alergias ou intoxicações.
[voltar para o início]
Manejo do paciente grave na sala de emergência
O manejo terapêutico deve ser realizado paralelamente à avaliação diagnóstica do paciente.
A abordagem deve priorizar as vias aéreas, a respiração e a circulação (do inglês, ABC: Airway, Breath, Circulation).
Se houver história ou suspeita de trauma, a coluna vertebral deve ser imobilizada.
A intubação deve ser considerada em pacientes que estão inconscientes a ponto de não se conseguir proteger a via aérea, mantê-la pérvia (por queda de língua, por exemplo) ou que têm respiração ineficaz ou hipoxemia.
Uma das primeiras medidas específicas em pacientes com alteração do nível de consciência é checar a glicemia capilar. Quando não for possível aferi-la rapidamente pode-se empiricamente realizar um bolus endovenoso de 15 g de glicose hipertônica (glicose 50% 3 ampolas IV agora). Em pacientes etilistas ou gravemente desnutridos, o bolus de glicose deve ser precedido por reposição de tiamina 100 mg IV para evitar encefalopatia de Wernicke (caracterizada por confusão mental, ataxia e alterações de motricidade ocular, choque e coma).
Se houver suspeita de hipertensão intracraniana, o paciente deve ser colocado em decúbito dorsal horizontal (DDH) com cabeceira elevada a 30°. Enquanto a avaliação ABC é realizada, deve-se obter acesso intravenoso (IV), oximetria para monitorar a saturação de oxigênio e iniciar a oxigenoterapia se indicado. A hipotensão deve ser inicialmente tratada com ressuscitação volêmica, com a consideração de uso de suporte vasopressor ou inotrópico precoces.
O tratamento específico depende da etiologia do rebaixamento do nível de consciência (RNC) subjacente. Nos casos em que houver suspeita clínica de toxicidade podem ser utilizados antídotos específicos.
Figura 5
[voltar para o início]
Literatura recomendada
- Cooksley T, Holland M. The management of coma. Medicine. 2016. http://dx.doi.org/10.1016/j.mp- med.2016.12.001.
- Edlow JA, Rabinstein A, Traub SJ, Wijdicks EF. Diagnosis of reversible causes of coma. Lancet. 2014;384:2064.
- Hinson JS, Martinez DA, Cabral S, George K, Whalen M, Hansoti B, et al. Triage performance in emergency medicine: A systematic review. Annals of Emergency Medicine. 2018.
- Kleinman ME, et al. Adult Basic Life Support and Cardiopulmonary Resuscitation Quality: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015 Nov 3;132(18 Suppl 2):S414-35.
- Link MS, et al. Adult Advanced Cardiovascular Life Support: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015 Nov 3;132(18 Suppl 2):S444-64.
- Soar J, Nolan JP. Airway management in cardiopulmonary resuscitation. Curr Opin Crit Care. 2013 Jun;19(3):181-7.
- Vincent JL, Ince C, Bakker J. Circulatory shock – an update: a tribute to Professor Max Harry Weil. Crit Care. 2012;16:239.
- Weil MH, Shubin H. Proposed reclassification of shock states with special reference to distributive defects. Adv Exp Med Biol. 1971;23:13-23.
 Soft Skills na medicina
Soft Skills na medicina













